CRISPR基因编辑技术是生物医学领域的关键技术,然而,CRISPR系统可能存在的脱靶效应是制约其临床应用的障碍。虽然领域内已开发了若干CRISPR基因编辑脱靶效应预测的计算模型,但是这些模型尚缺乏对于CRISPR系统分子机制、特别是其动力学机制的深入理解,其全基因组范围内的脱靶预测结果往往差强人意。
近日,同济大学上海自主智能无人系统科学中心、生命科学与技术学院、自主智能无人系统全国重点实验室、教育部自主智能无人系统前沿科学中心刘琦教授课题组,联合之江实验室、罗氏上海创新中心和中国农业科学院等团队在Nature Communications上发表了题为Genome-wide CRISPR off-target prediction and optimization using RNA-DNA interaction fingerprints的文章,发布了领域内首个基于分子互作指纹的CRISPR靶向效应预测和sgRNA优化模型CRISOT。针对CRISPR脱靶预测中面临的瓶颈,融合分子动力学(molecular dynamics, MD)模拟和人工智能(artificial intelligence, AI)技术,利用MD模拟分析和构建CRISPR的RNA-DNA分子互作指纹,结合AI算法开发CRISPR脱靶预测模型,并提出有效的向导RNA(sgRNA)优化方法。GUIDE-seq和WGS实验均证明CRISOT在全基因组脱靶效应预测和sgRNA优化上的高准确率和泛化性能。
图1. 论文:Genome-wide CRISPR off-target prediction and optimization using RNA-DNA interaction fingerprints
本研究开发的CRISOT工具包包含四个模块(图1),即CRISOT-FP、CRISOT-Score、CRISOT-Spec和CRISORT-Opti,分别用于分子互作指纹生成、全基因组CRISPR脱靶预测、sgRNA靶向特异性评估和Cas9系统的sgRNA优化。
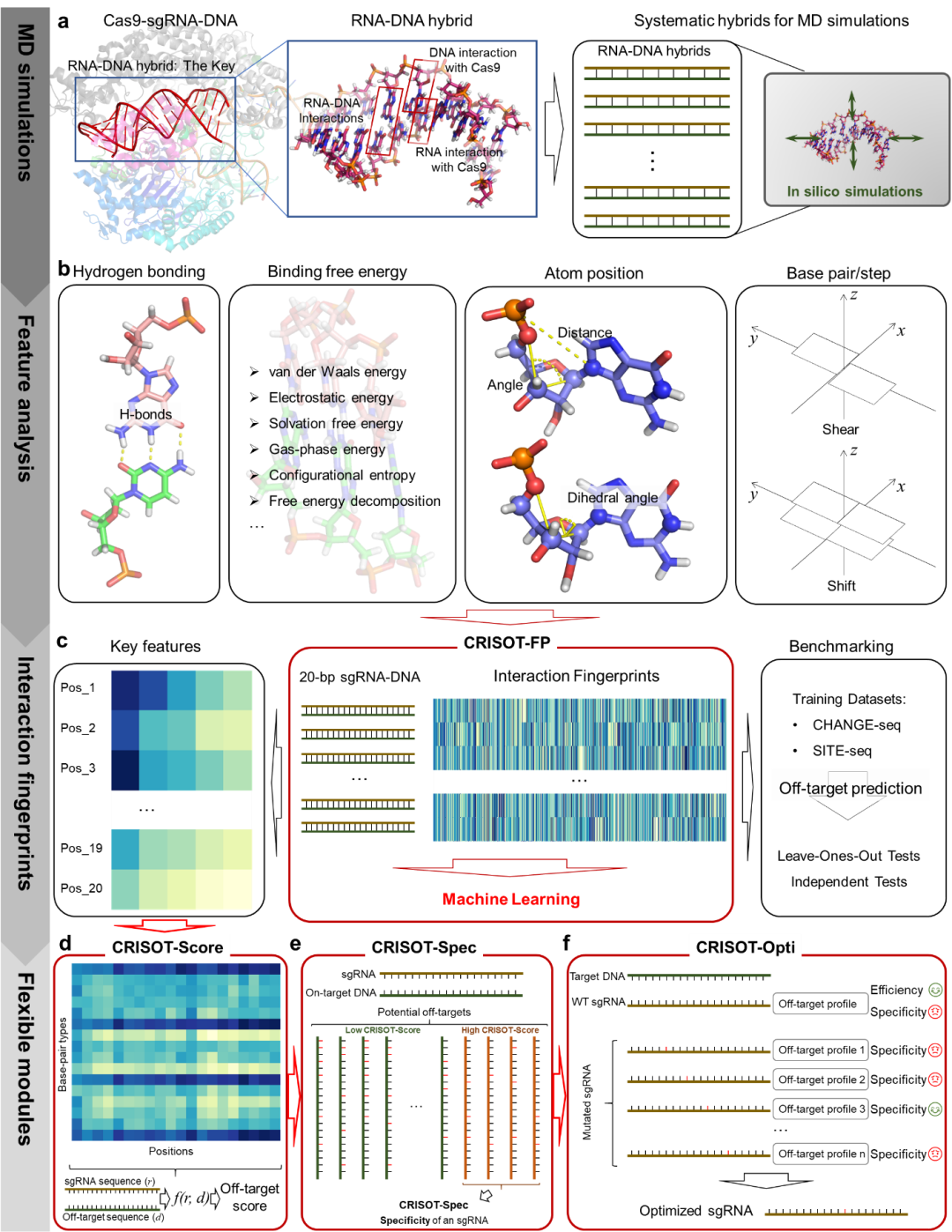
图2. 结合分子机制的Cas9靶向效应预测的计算框架
CRISPR-Cas9介导的DNA剪切的分子机制,是由Cas9-sgRNA-DNA复合体内部的一系列互作驱动的,这些分子互作也决定了其脱靶效应的产生。本研究以Cas9-sgRNA-DNA复合体的核心——sgRNA-DNA为基础(图1a),设计并开展MD模拟表征CRISPR系统的RNA-DNA分子互作特征,包括氢键、结合自由能、原子位置和碱基对的几何特征等(图1b),这些特征构成了sgRNA-DNA的分子互作指纹,即CRISOT的第一个也是首要的模块——CRISOT-FP(图1c)。CRISOT-FP可以作为一种分子指纹(表征), 以一种灵活的方式与不同的AI模型结合,用于预测CRISPR脱靶效应,本研究开发的模型表现出优秀的脱靶效应预测能力。
在此基础上,本研究将关键互作特征用于开发一个全新的、高效的脱靶效应打分方法,即CRISOT-Score(图1d),用于计算给定脱靶序列的脱靶打分。基于CRISOT-Score,通过叠加sgRNA在全基因组范围内所有CRISOT-Score打分高的脱靶位点,得到衡量该sgRNA靶向特异性的打分,即CRISOT-Spec(图1e)。最后,本研究基于CRISOT-Score和CRISOT-Spec,开发了一种创新性的优化sgRNA的方法,即CRISOT-Opti(图1f)。面向靶向特异性不尽如人意的sgRNA,CRISOT-Opti通过引入单碱基突变获得突变体sgRNA并从中识别能维持一定打靶活性同时靶向特异性大大提升的突变体sgRNA。本研究通过全面的计算和实验测试表明,CRISOT相较于现有工具的脱靶预测性能获得了很大的提升,且在准确预测BE(base editor)和PE(prime editor)的脱靶效应方面显示出潜力,表明RNA-DNA分子互作指纹捕获了不同CRISPR系统之间RNA-DNA相互作用的潜在机制。本研究所采用的引入MD的方法,本质上是一种结合物理先验的AI方法,可以克服全基因组范围内脱靶预测模型对于大量训练样本的依赖,体现出一种考虑物理先验的小样本和可解释性的AI思想。基因编辑作为一种疾病干预手段,已逐渐进入临床阶段,近日(2023.11.16),全球首个基于CRISPR-Cas9的基因编辑疗法CASGEVYTM在英国获得有条件的上市许可,用于治疗镰刀状细胞贫血病(SCD)和输血依赖性 β 地中海贫血(TDT),然而,其潜在脱靶问题及由此带来的健康风险仍将持续受到关注。本研究通过WGS实验表明,CRISOT成功优化了靶向原发性高胆固醇血症关键基因PCSK9和镰刀状细胞贫血病关键基因BCL11A的sgRNA,提高了其靶向特异性,表明CRISOT是全基因组CRISPR脱靶预测、评估和sgRNA优化的一个有效和可推广的系统,可降低CRISPR基因组编辑中的脱靶风险。可以预见,CRISOT将有助于sgRNA设计和优化,推动基因编辑进入临床级别的应用。该论文通讯作者是同济大学刘琦教授、原罗氏上海创新中心张清博士和中国农业科学院左二伟研究员,共同第一作者为之江实验室陈钦畅、同济大学啜国晖和中国农业科学院张海航。获得了罗氏上海创新中心和同济大学上海自主智能无人系统科学中心的大力支持。该工作目前依托罗氏和同济大学,已申请国际PCT专利一项,后续正在开展进一步的临床转化研究。 同济大学上海自主智能无人系统科学中心刘琦教授团队 (https://bm2.tongji.edu.cn) 致力于组学人工智能赋能的精准医学研究。前期,刘琦教授团队创新性地提出了基于元学习(Meta Learning)和神经图灵机(Neural Turning Machine)的AI计算框架,相关成果发表于Nature Machine Intelligence上。同时,刘琦教授团队在基因编辑系统的AI优化设计和新型基因编辑系统识别领域开发了一系列AI计算平台:于2018年发布了领域内首个基于预训练大模型的基因编辑优化设计平台DeepCRISPR(Genome Biology 2018);于2020年发布了领域内首个脱靶预测基准评估的计算平台iGWOS(Nucleic Acids Research 2020); 于2022年提出了结合MD和AI进行基因编辑系统优化和识别的观点论文(Science Bulletins 2022)。本次工作是在上述研究基础上的进一步突破。
原文链接:https://www.nature.com/articles/s41467-023-42695-4




